Blog
Nitrógeno amoniacal en agua y efluentes
nitrógeno amoniacal,agua y efluentes
En aguas y aguas residuales, las formas de nitrógeno
de mayor interés son, en orden decreciente de estado de oxidación, nitrato,
nitrito, amoniaco y nitrógeno orgánico. Todas estas formas de nitrógeno, así como
el nitrógeno gaseoso (N2), están sujetas bioquímicamente a cambios y
son componentes del ciclo del nitrógeno.
El amoníaco está presente de forma natural en los cuerpos de agua como producto de la degradación de compuestos orgánicos e inorgánicos en el suelo y el agua, resultante de la excreción de biota, reducción del nitrógeno gaseoso en el agua por microorganismos o por intercambio de gases con la atmósfera. El amoníaco también es un constituyente común en las aguas residuales sanitarias, resultado directo de las descargas de efluentes domésticos e industriales, la hidrólisis de urea y la degradación biológica de aminoácidos y otros compuestos orgánicos nitrogenados.
TOXICIDAD
En soluciones acuosas, el amoniaco puede estar presente
en forma ionizada (NH4+) o no ionizada (NH3)
según el pH, siendo estas formas intercambiables cuya suma está constituida por
amoniaco total o nitrógeno amoniacal total. Ambas formas son dañinas para la
biota acuática, sin embargo, la forma no ionizada es más tóxica en comparación
con la forma ionizada. Este hecho está relacionado con su permeabilidad a
través de la membrana celular de los peces y pequeños vertebrados presentes y
su solubilidad en lípidos que en estos provocan efectos letales en los ríos.
Además, el amoníaco puede unirse a metales pesados, formando complejos
considerados tóxicos.
Los seres humanos y los animales superiores son menos sensibles al amoníaco en el agua, pero el consumo prolongado de agua que contenga más de 1 mg/ (ppm) de amoníaco puede ser perjudicial para el organismo. Las soluciones con concentraciones superiores a 1000 mg/L (ppm) pueden causar quemaduras graves y cicatrices en la piel sensible y las membranas mucosas.
MÉTODO DE DETERMINACIÓN: DESTILACIÓN PRELIMINAR + TITULACIÓN
La concentración de amoniaco y la presencia de
interferentes son los dos factores principales que influyen en la selección del
método de determinación. En general, la determinación manual directa de
concentraciones bajas de amoníaco se limita al agua potable, aguas
superficiales limpias o subterráneas y efluentes de aguas residuales
nitrificadas de buena calidad. En otros casos, y cuando exista interferencia,
es necesario un paso de destilación preliminar.
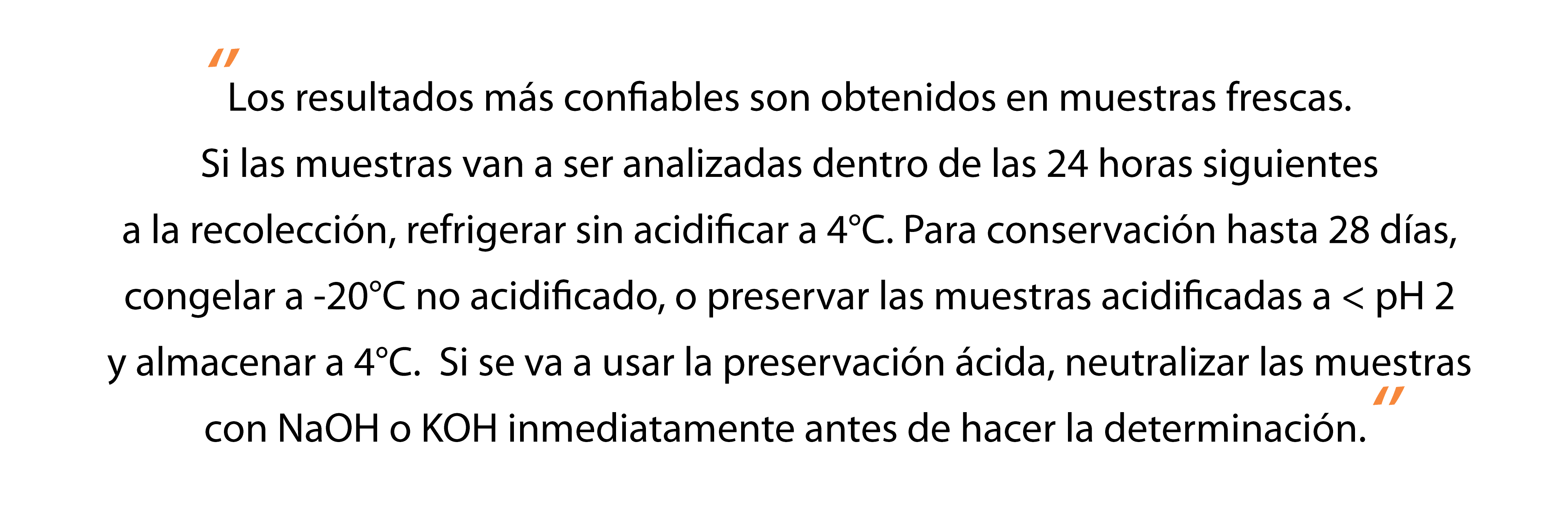

Cámara fría con control de temperatura, modelo TE-4030/1, incubadora, modelo TE-371/240L, cámara de conservación, modelo TE-385
Esta nota de aplicación se refiere al procedimiento de
destilación y titulación, utilizado especialmente para concentraciones de NH3-N
superiores a 5 mg/L, donde la muestra se destila, se trata con ácido bórico y
se titula con solución H2SO4. La titulación finaliza
cuando la solución cambia de color a lila/lavanda pálido.
La muestra se tampona a un pH 9.5 con un tampón de
borato para disminuir la hidrólisis de cianatos y compuestos nitrogenados orgánicos
y se destila en una solución de ácido bórico, determinando el amoníaco por
titulación con una solución estándar de H2SO4.
- Para muestras de lodos o sedimentos: pese rápidamente alrededor del 1%
de muestra húmeda, equivalente a aproximadamente 1 g de peso seco, en un
recipiente de pesaje o crisol. Lavar la muestra en un matraz de 500 mL con agua
y diluir a 250 mL. Destilar, pero agregar un trozo de cera de parafina a la
botella de destilación y recolectar solo 100 mL de destilado.
PROCEDIMIENTO
1. Homogeneizar la muestra
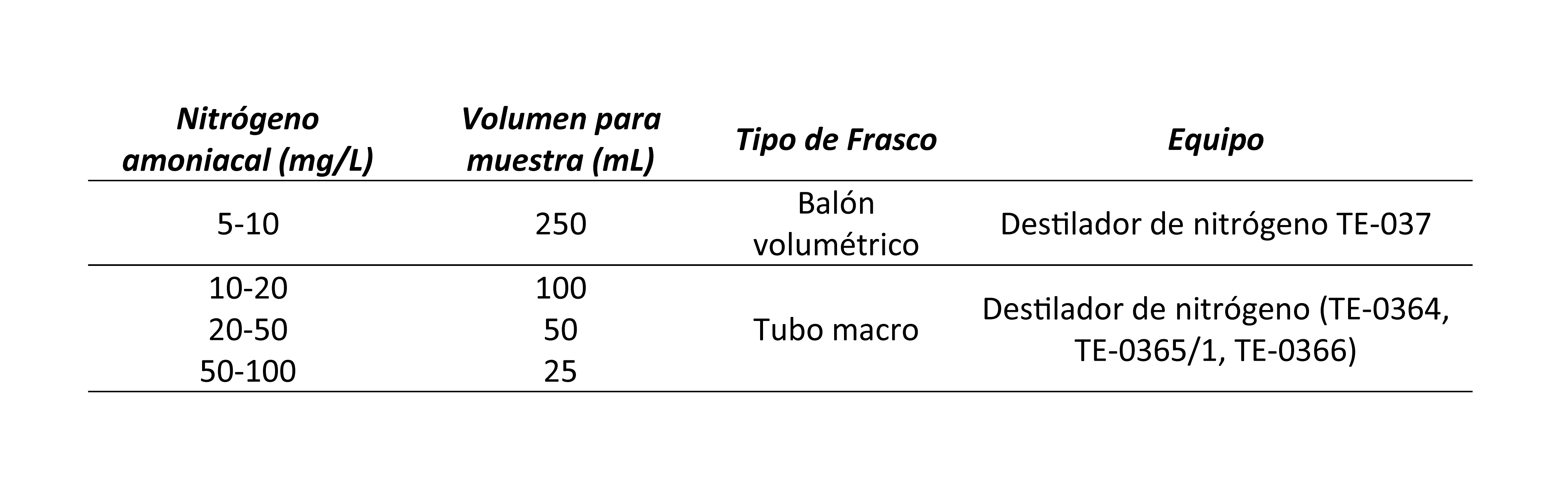
2. Retire una alícuota representativa en relación con la cantidad de
nitrógeno amoniacal presente en la muestra de acuerdo con la tabla 1 y
transfiérala a un vaso de precipitado. Las muestras con una concentración más
alta deben diluirse.
Tabla 1. Parámetros para definir el volumen de la muestra y el tipo de frasco utilizado.
3. Adicionar 25mL de Solución buffer de Borato.
4. Ajustar el pH para 9,5 con Hidróxido de Sodio 6N.
5. Reservar.
6. Adicionar 50mL de Solución absorbente de Ácido bórico en un balón volumétrico
de 250 mL.
7. Transferir la muestra preparada y reservada para el frasco seleccionado
de acuerdo con la tabla 1
8. Conectar el frasco al destilador.
9. Destilar a razón de 6 a 10
mL/min.
10. Acoplar un erlenmeyer de 250 mL con 50 ml de solución de Ácido bórico
en la salida del destilado, de modo que la manguera de salida esté sumergida en
la solución.
11. Colectar como mínimo 200 mL de destilado (para el lodo o sedimento,
colectar apenas 100 mL).
12. Transferir el contenido para un vaso de precipitado de 600 mL.
13. Realice la titulación de amoniaco en el destilado con solución de
titulación estándar H2SO4 (0; 02N) hasta que se produzca
un cambio de color a lavanda pálido. Para la titulación, se puede utilizar una bureta
digital o un titulador.
14. Hacer un blanco en todas las etapas del procedimiento y aplicar la
corrección necesaria a los resultados.
CÁLCULO:

Donde, A= Volumen (mL) de H2SO4 titulado para la muestra,
y B= Volumen (mL) de H2SO4 titulado para el blanco.
El agua utilizada para
preparar las soluciones utilizadas en los análisis de laboratorio debe estar
libre de impurezas orgánicas e inorgánicas para garantizar resultados precisos
y reproducibles. Para obtener agua de calidad, se deben utilizar equipos como destiladores de agua u osmosis reversa. Obtenga más información sobre el TRATAMIENTO Y FILTRADO DE AGUA PARA ANÁLISIS DE LABORATORIO en el artículo en nuestro blog.

CONSIDERACIONES FINALES
Los compuestos nitrogenados presentes en aguas y efluentes
son nocivos para el medio ambiente, impactando la vida de los organismos
acuáticos, además de ser un riesgo para la salud humana. El amoníaco es la
forma más común en la que el nitrógeno se encuentra en los efluentes de las
aguas residuales domésticas crudas (VON SPERLING, 2002), siendo un parámetro
físico-químico importante a analizar. Se enfatiza la importancia de evaluar la
concentración esperada de amoniaco en la muestra y la presencia de
interferentes, con el fin de seleccionar la metodología adecuada y garantizar
resultados satisfactorios.
La concentración de amoníaco permitida en el agua
potable, así como los patrones de descarga de efluentes de fuentes de
contaminación a los cuerpos de agua varían según la legislación ambiental de
cada país. En Brasil, la Resolución 430/2011 del Consejo Nacional del Ambiente
(CONAMA), que establece las condiciones y estándares para la descarga de
efluentes, determina que el límite máximo de nitrógeno amoniacal total en
liberaciones es de 20.0 mg/L.
SOLUCIONES UTILIZADAS:
Solución buffer de borato: adicionar 88 mL de solución de NaOH 0,1N a
500 mL aproximadamente de solución de tetraborato de sodio 0,025M (Na2B4O7)
(9,5 g de Na2B4O7 • 10 H2O/L) y diluir a 1 L.
Solución de indicador mixto: disolver 200 mg de indicador rojo de metilo
en 100 mL de alcohol etílico 95% o isopropílico. Disolver 100 mg de azul de
metileno en 50 mL de alcohol etílico 95% o alcohol isopropílico. Combinar soluciones. Preparar mensualmente.
ACERCA DE TECNAL
La misión de Tecnal es contribuir al desarrollo científico,
tecnológico y a la industria nacional e internacional a través de la
fabricación y venta de equipos científicos, la prestación de servicios
especializados y la difusión del conocimiento.
La empresa busca crecer de manera innovadora y sustentable, enfocada en la continuidad y excelencia operativa, para convertirse en una referencia en el mercado brasileño e internacional de equipos científicos. Hable con nosotros: por Teléfono/WhatsApp +55 (19) 2105-6161, correo electrónico comex@tecnal.com.br o por el sitio web haciendo clic aquí.
REFERENCIAS
APHA, Standard Methods for the
Examination of Water and Wastewater. E.W.
Rice, R.B. Baird, A.D. Eaton, L.S. Clesceri, editors. 23ª ed. Washington: American Public
Health Association, 2017. 1496p.
Brasil. Ministério do Meio Ambiente. CONAMA. Resolução nº 430, de
13 de maio de 2011. Dispõe sobre as condições e padrões de lançamento de
efluentes, complementa e altera a Resolução no 357, de 17 de março de 2005, do
Conselho Nacional do Meio Ambiente.
Von Sperling, M. Lodos ativados. v. 4. Belo Horizonte: Departamento de Engenharia Sanitária e Ambiental; Universidade Federal de Minas Gerais, 2002. 428 p



