Blog
8 dúvidas clássicas sobre a digestão na análise de proteína
digestão,proteína,análises
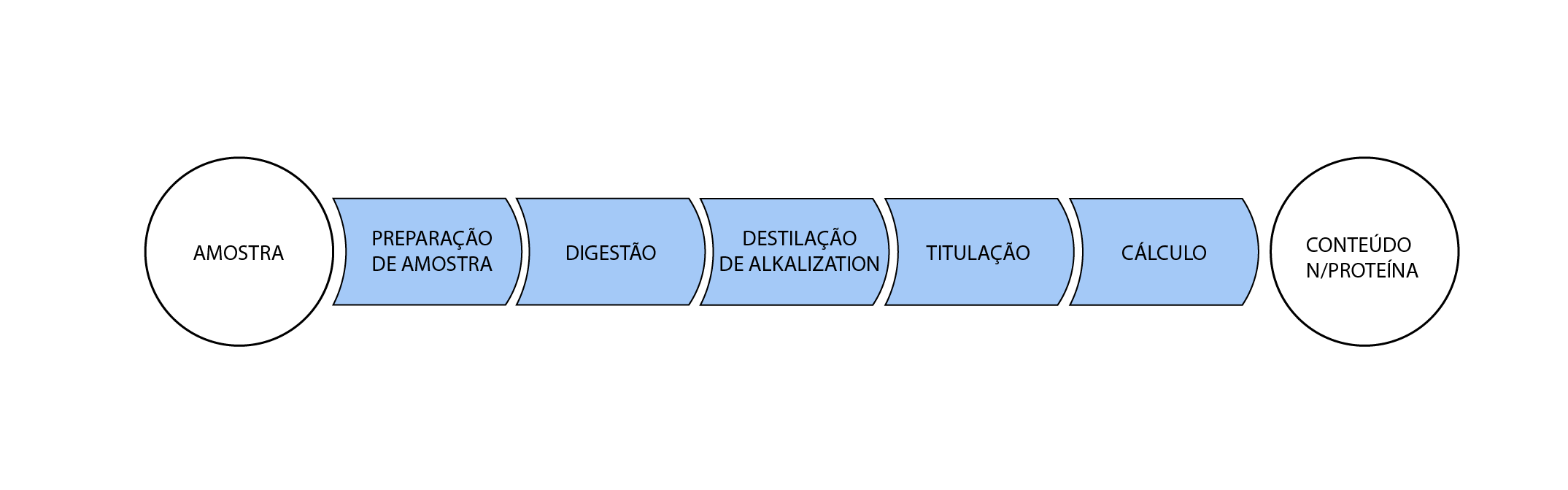
A digestão é a primeira etapa da
análise de proteína pelo método Kjeldahl, e ocorre após a amostragem e preparo da amostra.
O método de determinação de nitrogênio
total foi desenvolvido há mais de 130 anos pelo dinamarquês Johan Gustav Kjeldahl,
e desde então, tem sido estudado, modificado e melhorado. O método Kjeldahl
é referência ou padrão para quantificar o teor de proteína em alimentos, sendo
recomendado por órgãos normalizadores como AOAC e ISO. Esse método quantifica o teor de nitrogênio
total e estima indiretamente o teor de proteína dos alimentos.
Método Kjeldahl
O método consiste na digestão
com ácido sulfúrico concentrado e uma mistura catalítica para acelerar a
reação, seguida de destilação com hidróxido de sódio para liberação do
íon amônio que é retido em ácido bórico.
A última etapa é a titulação com
ácido forte padronizado para quantificação do nitrogênio total presente na
amostra. O teor de proteína é então estimado indiretamente através de
cálculo, multiplicando o teor de nitrogênio por um fator de conversão.
O resultado final da análise, ou seja, o teor de proteína, é dependente da qualidade de cada etapa do processo analítico.
Digestão
A digestão baseia-se no aquecimento da amostra com ácido sulfúrico até que os compostos orgânicos sejam oxidados. O nitrogênio da amostra (orgânico) é reduzido e transformado em sulfato de amônio (inorgânico) que é uma substância estável. Nessa etapa utiliza-se uma mistura catalítica com a finalidade de elevar temperatura de ebulição do ácido e aumentar a velocidade de oxidação da matéria orgânica, encurtando o tempo necessário para a digestão.
A temperatura de ebulição do ácido
sulfúrico concentrado é de cerca de 330 °C, e com a adição de um sal como
sulfato de potássio (K2SO4), por exemplo, a temperatura
da solução de digestão pode ser elevada a 390 °C ou mais, dependendo da
proporção de sal para ácido.
Durante a digestão, o carbono é transformado em dióxido de carbono (CO2) e o hidrogênio em água (H2O). Além disso, o nitrogênio que existe sob a forma de amina, amida e nitrila é transformado em amônia (NH3) a qual reage com o H2SO4, formando o sulfato de amônio ((NH4)2SO4) durante a digestão – conforme mostrado nas reações abaixo, e esse ao se resfriar pode formar cristais (GALVANI, GAERTNER, 2006).
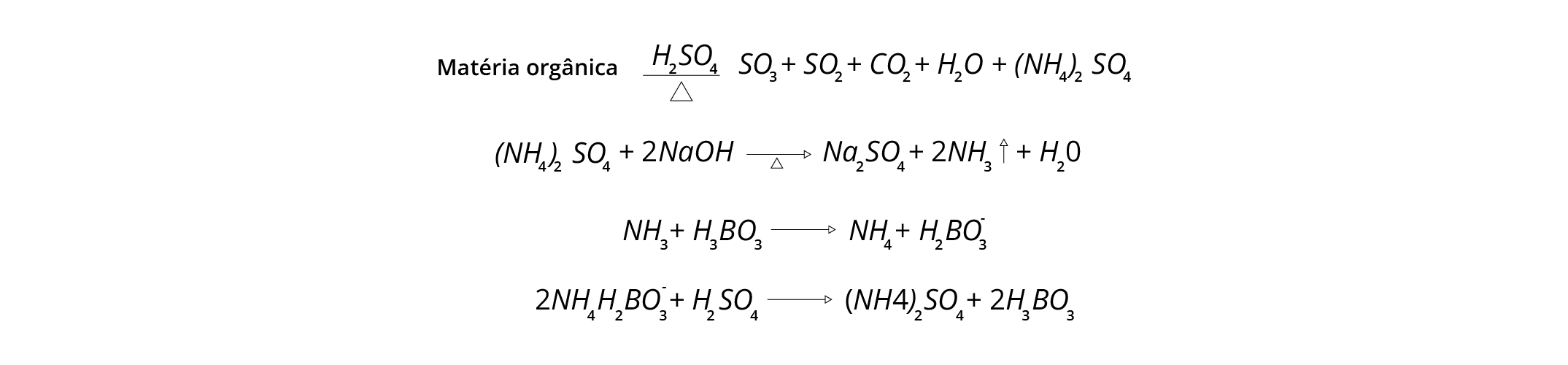
Embora todas as etapas sejam críticas
para o resultado final da análise, a digestão é umas das que mais geram dúvidas
quanto a sua execução. Pensando facilitar e solucionar os questionamentos, elaboramos
uma relação das perguntas mais frequentes.
1) A digestão precisa ser realizada em capela de exaustão de gases?
Sim, o bloco deve ser instalado
dentro da capela. A função primária da capela de exaustão é exaurir vapores e
gases e funcionar como uma barreira física, oferecendo proteção aos usuários
contra o derramamento de solução, quebra de vidraria, manipulação de reagentes
e demais problemas que possam ocorrer durante a digestão ácida.
2) É necessário o uso do Scrubber seco, modelo TE-154/1, mesmo quando a digestão é realizada no
interior da capela de exaustão de gases?
Conforme resposta anterior, a capela
é responsável por exaurir os vapores e gases tóxicos, entretanto, somente a
capela, sem a presença de um sistema complementar, não faz nenhum tipo de
neutralização ou tratamento dos gases tóxicos.
O Scrubber Seco garante o correto tratamento dos gases e vapores lançados a atmosfera, contribuindo para maior proteção ao meio ambiente, ao minimizar os impactos negativos.
3) Qual volume de tubo utilizar?
O método é usualmente classificado em
macro, semi-micro ou semi-macro e micro, conforme a quantidade de amostra
submetida à digestão para análise. Os parâmetros que diferem um do outro são:
massa de amostra (variando de miligramas a gramas ou ml), volume de ácido
sulfúrico, tamanho das vidrarias utilizadas e equipamentos de digestão.
Embora a classificação do método irá
depender da normativa ou diretriz adotada, é possível considerar a seguinte
definição em relação ao tamanho da vidraria:
· Micro: tubos com capacidade TOTAL para até 100ml, equivalente ao Bloco digestor micro com rampas e patamares, modelo TE-041/25, não recomendado para amostras líquidas.
· Semi Micro ou Semi Macro: tubos com capacidade TOTAL para
aproximadamente 400ml, equivalente ao Bloco digestor macro com touch
screen, modelo TE-0081/50. Pode ser utilizado para
amostras líquidas e sólidas.
· Macro: tradicional
digestor da técnica desenvolvida por Johan Gustav Kjeldahl, composto por balões com capacidade TOTAL
entre 500ml e 800ml. Pode ser utilizado para amostras líquidas e
sólidas.
O fator determinante na escolha do método
de Kjeldahl é o teor de nitrogênio na amostra. Somado a isso, o estado
físico da amostra (líquida ou sólida), também influencia na escolha do protocolo.
Cabe salientar que a quantidade de
amostra a ser analisada depende do teor de nitrogênio esperado e do grau
de homogeneidade do material.
Quanto maior o teor de nitrogênio da amostra, menor a massa de amostra requerida e consequentemente, menor é o tamanho do tubo. Abaixo uma sugestão para escolha do método ou tamanho do bloco/tubo de digestão:

*amostra + reagentes
4) Como calcular a massa de amostra correta?
O teor de nitrogênio ideal varia de 1
a 200 mg de nitrogênio por tubo de ensaio de vidro. O limite de determinação é
0,02 mg de nitrogênio por tubo de ensaio. Com base nesse dado pode-se calcular
a correta massa de amostra a ser digerida.
5) Qual a temperatura de aquecimento para digestão?
A temperatura ideal para digestão é definida em função do tipo de amostra
e protocolo adotado. Entretanto, é recomendável que ela não ultrapasse de 430
°C. Uma faixa de 370°C a 400 °C, costuma atender os diferentes tipos de
alimentos.
As temperaturas superiores a 390°C, a
formação de gás nitrogénio (N2) torna-se uma possibilidade, por
favorecer a perda de nitrogênio por pirólise. Tal condição pode afetar a
precisão do resultado final, por reduzir os teores de nitrogênio na amostra.
A perda de nitrogênio por
volatilização é uma das razões do aquecimento ser gradual e não de maneira
brusca.
No início da digestão reação pode ser
um pouco lenta, sendo esperada uma temperatura mais elevada no final do
processo de digestão, em função do consumo gradual do ácido. Contudo, fatores
como a entrada de calor, o consumo de ácido pelo material orgânico e a vaporização,
a relação sal / ácido, o tempo de digestão e o tipo do frasco Kjeldahl, estão
todos interrelacionados e influenciam na temperatura final da solução.
6) Volume de ácido sulfúrico utilizado?
A quantidade de ácido necessária é
influenciada pelo tamanho da amostra e quantidade relativa de carbono e
hidrogênio na amostra, bem como a quantidade de nitrogênio. Além disso, uma
amostra muito rica em gordura consome uma quantidade maior de ácido.
Portanto, a quantidade de ácido a ser
inicialmente adicionada deve ser suficiente para a digestão da amostra sem
esses interferentes e deve ser incrementada à medida que a massa de amostra
e/ou interferentes aumentam.
Vale salientar que os incrementos no
volume de ácido estão previstos nos protocolos, uma vez que estes já foram
validados para os tipos de amostras aos quais se destinam.
7) Qual a proporção ideal de ácido sulfúrico e catalisador?
A relação entre o ácido sulfúrico e
os sais de sulfato é crucial para a ebulição temperatura a ser atingida. A
relação ideal de ácido sulfúrico e catalisador é de aproximadamente 2 mL de
H2SO4 por 1 g de catalisador
8) Quando finaliza a digestão?
O processo de digestão está finalizado quando ocorre a mudança de cor da amostra digerida para verde ou azul claro e transparente ou límpido (a tonalidade azul ou verde dependerá do catalizador utilizado). Após a mudança de cor é necessário aguardar 30 a 40 minutos, para reação se completar.

|
|
|
|
Sobre a Tecnal
A Tecnal tem como missão contribuir para o desenvolvimento científico, tecnológico e com a indústria nacional e internacional por meio da fabricação e da comercialização de equipamentos científicos, da prestação serviços especializados e da disseminação do conhecimento. A empresa busca crescer de maneira inovadora e sustentável, focada na continuidade e na excelência operacional, de forma a tornar-se uma referência no mercado brasileiro e internacional de equipamentos científicos. Fale conosco: Telefone/WhatsApp (19) 2105-6161, e-mail: contato@tecnal.com.br ou pelo nosso site clicando aqui.
Referências
AOAC: Official Methods of Analysis of
the Association of Official Analytical Chemists: Official Methods of Analysis
of AOAC INTERNATIONAL, 21st Edition (2019).
IAL, Instituto Adolfo Lutz. Métodos
físico-químicos para análise de alimentos. São Paulo: Instituto Adolfo Lutz, p.
1020, 2008.
International organization for
standardization. Milk — Determination of nitrogen content — Part
3: Block-digestion method (Semi-micro rapid routine method). ISO 8968-3:2004 [IDF 20-3:2004].
Geneva,2004.
GALVANI, F.; GAERTNER, E. Adequação da
metodologia Kjeldahl para determinação de nitrogênio total e proteína bruta.
Circular Técnica, Nº63. Corumbá: Embrapa Pantanal, 2006. p9. Disponível em: https://www.infoteca.cnptia.embrapa.br/bitstream/doc/812198/1/CT63.pdf


